Экспериментальное исследование биобезопасности и биоактивности нанокомпозитов и наногелей в комбинации с дентальными имплантатами из никелида титана
Эксперименты in vitro по исследованию биосовместимости образцов нанокомпозитов и исследование биосовместимости дентальных имплантатов типа «ТАЛ» в комбинации с нанокомпозитами показали, что никелид титана-серебряный нанокомпозит биобезопасен даже в высоких дозах, как и наночастицы входящих в него веществ - никелида титана и серебра. никелид-титановые имплантаты как без частиц серебра, так и в комбинации с никелид титана-серебряным нанокомпозитом являются биосовместимыми, причём биосовместимость имплантатов в присутствии частиц серебра, происходит значительно интенсивнее. Присутствие исследованных нанокомпозитов на поверхности никелид-титановых имплантов повышает их биосовместимость.
УДК.615.46:616.31
ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ БИОБЕЗОПАСНОСТИ И БИОАКТИВНОСТИ НАНОКОМПОЗИТОВ И НАНОГЕЛЕЙ В КОМБИНАЦИИ С ДЕНТАЛЬНЫМИ ИМПЛАНТАТАМИ ИЗ НИКЕЛИДА ТИТАНА
Р.М.Гизатуллин. ООО "Инновационный стоматологический центр "НАНО-ДЕНТ", Генеральный директор , академик РАМТН, Российская федерация, Москва
Н. И.Борисенко, Электростальский политехнический институт филиал ФГБОУ ВПО Университета машиностроения, академик РАМТН, кандидат технических наук, доцент, Российская федерация, Электросталь
Е.И.Зарайский. ЗАО "СТЭЛЛС" Заведующий. отделом биомедицинских технологий, кандидат биологических наук
EXPERIMENTAL STUDY OF BIOSAFETY AND BIOACTIVITY OF NANOCOMPOSITES AND NANOGELS IN THE COMBINATION WITH DENTAL IMPLANTS FROM THE NICHKEL
R.M.Gizatullin. Innovative dentistry centre NANO-DENT Ltd, general manager, academician RAMTS, Russian Federation, Moscow
N.I.Borisenko, Elektrostahl polytechnical institute branch of University of mechanical engineering, academician RAMTS, Candidate of Technical Sciences, assistant professor, Russian Federation, Electrostal
E.I.Zaraysky. JSC STELLS Manager. department of biomedical technologies
In vitro experiments on research of biocompatibility of samples of nanocomposites and research of biocompatibility of dental implants of the "TAL" type with nanocomposites have shown that titan nickelid - a silver nanocomposite biosafety even in high doses, as well as nanoparticles of substances entering into it – the titan nickelid and silver. nikelid-titanium implants both without silver particles, and in a combination with the titan nickelid - a silver nanocomposite are biocompatible, and biocompatibility of implants in the presence of silver particles, occurs much more intensively. Presence of the studied nanocomposites on a surface of nikelid-titanium implants increases their biocompatibility.
НАНОКОМПОЗИТ, НАНОГЕЛЬ, БИОСОВМЕСТИМОСТЬ, БИОАКТИВНОСТЬ. НИКЕЛИД ТИТАНА ДЕНТOИМПЛАНТАТ, ОСТРАЯ ТОКСИЧНОСТЬ, ХРОНИЧЕСКАЯ ТОКСИЧНОСТЬ, ЦИТОСТАТИЧЕСКИЙ ЭФФЕКТ
NANOCOMPOSITE, NANOGEL, BIOCOMPATIBILITY, BIOACTIVITY. NIKELID OF THE TITAN DENTOIMPLANTAT, SHARP TOXICITY, CHRONIC TOXICITY, CYTOSTATIC EFFECT
Для выяснения биобезопасности никелид титана-серебряного нанокомпозита (НТСН) в концентрациях, использованных для реконструкции челюстных костей, были проведены его испытания на острую токсичность, хроническую токсичность и цитостатический эффект с помощью первичных культур клеток человека. Для исследования использовали культуры мезенхимальных клеток костного мозга (МККМ) и эндометриальных фибробластов (ЭФ). МККМ получали из губчатого вещества гребня подвздошной кости, а ЭФ из фрагментов эндометрия, забранных в процессе операции по экстирпации матки. Свежие фрагменты ткани стерилизовали двадцатикратной обработкой средой следующего состава: RPMI 1640(Sigma) – 47,5%, DMEM (Sigma) – 47,5%, фетальная бычья сыворотка - FCS (Sigma) – 5%, суплемент, содержащий селен, ферритин, инсулин, сахарозу x1 (Sigma), гентамицин, пенициллин, стрептомицин, фунгизон (Sigma). Затем фрагменты отмывали пятикратно раствором Хенкса и обрабатывали 1%-ным раствором клостридиальной коллагеназы в течение 20 минут при 370С в атмосфере 6% CO2. Ткань после вышеописанной обработки диссоциировала на отдельные клетки. Клетки ресуспендировали в среде, содержащей 80% смеси RPMI 1640 и DMEM (1:1), 20% FCS, суплемент, глютамин, антибиотики, меркаптоэтанол (0,01%), доводили до концентрации 100000 клеток на мл и рассевали на 75-сантиметровые флаконы (Nunc). Клетки культивировали при 370 С и 6% CO2 до достижения монослоя. Смену среды производили каждые 2 дня. На 12-ый день после посадки флаконы содержали 70-80% монослой. Клетки снимали смесью версена и трипсина и рассевали на покрытые полилизином 96-луночные плоскодонные планшеты (Flow) в концентрации 20000 в мл. Избыток клеток рассевали на 75-сантиметровые флаконы (Nunc) в в концентрации 200000 клеток в мл. Культура эндометрия представляла собой гетерогенную популяцию с преобладанием фибробластоподобных стромальных элементов, образующих плотный практически прозрачный монослой сильно распластанных клеток. МККМ образовывал монослой, мезенхимальных клеток.
Изучение острой токсичности никелид титана–серебряного нанокомпозита проводили следующим образом. Монослойные клетки снимали смесью версена и трипсина и рассевали на покрытые полилизином 96-луночные плоскодонные планшеты (Flow) в концентрации 20000 в мл. Планшеты помещали на сутки в CO2-инкубатор. В течение суток клетки МККМ и ЭФ распластывались и начинали делиться. Через 24 часа после посадки клетки обрабатывали различными разведениями препаратов по следующей схеме:
| Концентрация препаратов | МККМ | ЭФ |
|---|---|---|
| 500 мкг/мл | x | x |
| 50 мкг/мл | x | x |
| 0 мкг/мл | x | x |
Каждый вариант был представлен тремя точками. После окончания инкубации клетки обрабатывали витальным красителем, содержащим этидиум бромид и акридин оранжевый. Процент жизнеспособных клеток подсчитывали под люминесцентным микроскопом фирмы «Opton» при увеличении x400. При окраске используемым красителем ядра живых клеток окрашивались в зелёный цвет, а мёртвых – в красный. Данные по точкам каждого варианта усреднялись. Результаты оценки острой токсичности препаратов на культуры МККМ и ЭФ 1, Как видно из таблицы 1 достоверной дозозависимой токсичности препаратов никелид титана -серебряного нанокомпозита даже в концентрации, которая в 10 раз превосходит используемую в вышеописанных изделиях не обнаружено. Для изучения хронической токсичности никелид титана -серебряного нанокомпозита использовали аналогичную схему. Отличием явился срок инкубации с исследуемыми препаратами, который составил 7 суток. Результаты исследования хронического токсического действия исследуемых препаратов на культуры клеток представлены в таблице 2. Как видно из таблицы 1 достоверной дозозависимой хронической токсичности препаратов никелид титана -серебряного нанокомпозита в присутствии используемых и 10-кратно повышенных концентрациях не выявлено. Типичные культуры представлены на рис.1-4. Живые клетки при окраске использованным витальным красителем окрашиваются в зеленый цвет, а мертвые – в красный. Фотографии наглядно иллюстрируют отсутствие острого и хронического цитоксического действия никелид титана -серебряного нанокомпозита на клетки культуры костного мозга. Цитостатическое действие препаратов никелид титана – серебряного нанокомпозита изучали двумя методами – окраской на активность митохондрий с использованием метилтиазолтетразолия, который превращается в формазан и после растворения в диметилсульфоксиде даёт синюю окраску, которая при длине волны 610 нм и с помощью окраски фиксированного параформальдегидом клеточного монослоя кристаллвиолетом, окраска которым учитывается при длине волны 590 нм. Схема эксперимента аналогична описанной выше. Результаты исследования приведены на рис. 1 и 2.
Таблица 1
Изучение острой токсичности препаратов никелид титана -серебряного нанокомпозита на культуры клеток МККМ и ЭФ (количество живых клеток на 100 клеток).
| Концентрация препаратов | Количество живых клеток МККМ | Количество живых клеток ЭФ |
|---|---|---|
| 500 мкг/мл | 99 | 100 |
| 50 мкг/мл | 100 | 98 |
| 0 мкг/мл | 98 | 99 |
Таблица 2
Изучение хронической токсичности препаратов никелид титана -серебряного нанокомпозита на культуры клеток МККМ и ЭФ (количество живых клеток на 100 клеток).
| Концентрация препаратов | Количество живых клеток МККМ | Количество живых клеток ЭФ |
|---|---|---|
| 500 мкг/мл | 100 | 100 |
| 50 мкг/мл | 100 | 98 |
| 0 мкг/мл | 99 | 100 |
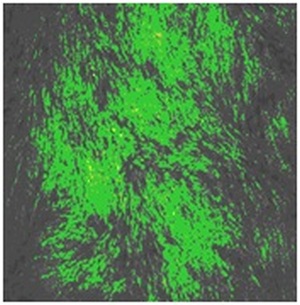
Рис. 1. Культура ЭФ, обработанная никелид титана-серебряным нанокомпозитом в концентрации 500 мкг\мл. Люминесцентная микроскопия, окраска витальным красителем, содержащим этидиум бромид и акридин оранжевый (х200).
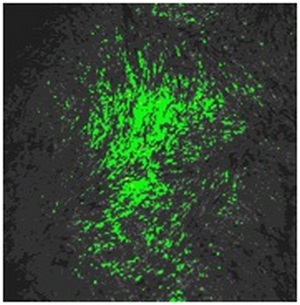
Рис. 2. Культура ЭФ без обработки (позитивный контроль).
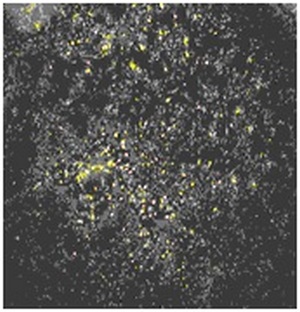
Рис. 3. Культура ЭФ, убитая температурным шоком (негативный контроль).
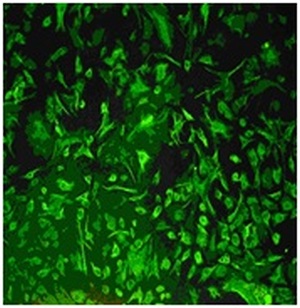
Рис. 4. Культура МККМ обработанная никелид-титана - серебряным нанокомпозитом. Люминесцентная микрофотография, окраска витальным красителем, содержащим этидиум бромид и акридин оранжевый (х400). Ядра погибших клеток окрашиваются в красный цвет.
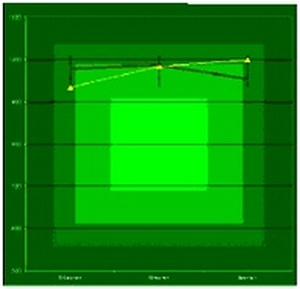
Рис. 5. Цитостатическое действие никелид титана - серебряного нанокомпозита на культуры клеток МККМ и ЭФ, измеренное с помощью метилтиазолтетразолия. По оси ординат – оптическая плотность при длине волны 610 нм. По оси абсцисс – концентрация препаратов.
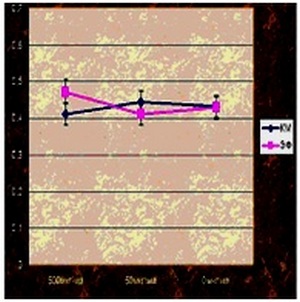
Рис. 6. Цитостатическое действие никелид титана -серебряного нанокомпозита на культуры клеток МККМ и ЭФ, измеренное с помощью окраски кристаллвиолетом монослоя, фиксированного параформальдегидом. По оси ординат – оптическая плотность при длине волны 590 нм. По оси абсцисс – концентрация препаратов.
Видно из рис.5 и 6 статистически достоверного цитостатическое действия никелид титана-серебряного нанокомпозита не удается обнаружить ни одним из использованных методов ни на одной исследованной культуре. Также было проверено цитотоксическое действие имплантатов из никелида титана в комбинации с НТСН, нанесённым на поверхность имплантатов методом УЗ микширования в плазме крови.
Для исследования использовали клетки эпителия человека, культивированные, как описано выше. Стерилизованые спиртовой обработкой в течение 30 мин и высушенные под ламинарным потоком стерильного воздуха импланты покрытые и не покрытые титаном помещали в стерильные чашки Петри (Nunc) и заливали культуральной средой для контрольной культуры клеток, содержащей 80% смеси RPMI 1640 и DMEM (1:1), 19% FCS, суплемент, глютамин, антибиотики, меркаптоэтанол (0,01%).
Для экспериментальной группы клеток в культуральную среду УЗМ вносили 1% НТСН . Затем в чашки помещали клетки из расчета 100 тыс/мл и инкубировали в атмосфере 6% С02 в течение 1 и 7 суток. После каждой инкубации клетки окрашивали смесью акридин-оранжевого и этидиум-бромида и подсчитывали жизнеспособность.
Было показано, что через сутки жизнеспособность клеток во всех трех вариантах:
1. клетки + имплант без НТСН,
2. клетки + имплант + НТСН,
3. контрольная культура клеток
составила 98-99%. Таким образом было продемонстрировано, что имплантаты не обладают острым цитотоксическим эффектом. Через 7 суток на поверхности имплантатов наблюдали заселение клеток. На рис.7 и 8 представлен участок никелид-титанового имплантата без НТСН в проходящем свете (рис.7). На рис.9 и 10 представлен участок никелид-титанового имплантата с НТСН в проходящем свете (рис. 9) и при освещении, возбуждающем люминесцентное свечение живых клеток (рис. 10).

Рис. 7. Никелид-титановый имплантат без НТСН в проходящем свете.
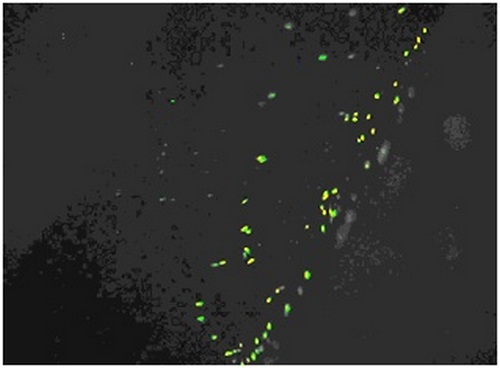
Рис. 8. Тот же участок никелид-титанового имплантата без НТСН, люминесцентная окраска. Видны зеленые клетки.

Рис. 9. Никелид-титановый имплантат с НТСН в проходящем свете.

Рис. 10. Тот же участок никелид-титанового имплантатас НТСН, люминесцентная окраска. Видно небольшое количество зеленых клеток и желтую ауто –люминесценцию имплантата.
Из приведенных снимков можно сделать два вывода. Во-первых хроническое токсическое действие никелид титана -серебряного нанокомпозита на поверхности имплантатов не обнаружено (мёртвые клетки при данном окрашивании окрашиваются в красный цвет, что на вышеприведённых снимках не обнаружено. Во-вторых как имплантаты без НТСН, так и в комбинации с НТСН заселяются клетками, причём заселение имплантатов с НТСН , происходит значительно интенсивнее.
Также было проведено изучение цитотоксического действия гидроксиаппатит-коллаген-содержащей губки «Стимул-Осс», которую также используют для имплантации в качастве носителя нанокомпозитов. На рис. 11 показана микрофотография фрагментированной губки, помещённой в чашку Петри с клетками, аналогично опыту с имплантатами. На первые и седьмые сутки цитотоксичности губки не наблюдали (рис. 2.4.12).
Результаты исследований предоставлены «ИСЦ «НАНО-ДЕНТ» группой исследования стволовых клеток Института Биологии Гена РАН (Москва, 2009 г.). Предварительные тесты in vitro на биосоместимость проводились по стандартной методике. В процессе эксперимента порошок никелида титана соединялся с культурой клеток тканей печени человека на бионейтральном субстрате. На серии микрофотографий (Рис.13) хорошо видно, что клетки тканей печени человека в контакте с частицами никелида титана не только выживают (Рис.13 а-в), но и демонстрируют тенденцию перемещаться с бионейтрального субстрата на поверхность частиц (Рис. 13 г).

Рис. 11. Дефрагментированная губка «Стимул-Осс» в проходящем свете.
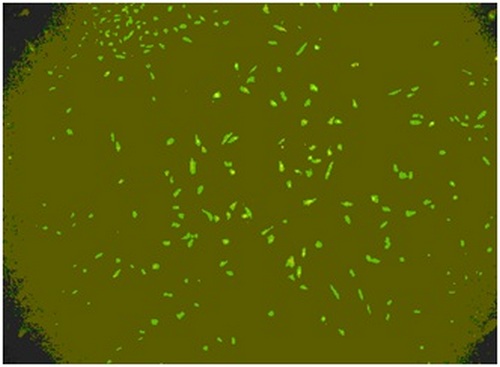
Рис. 12. Тот же участок чашки Петри, люминисцентная окраска. Видно большое количество живых зеленых клеток.
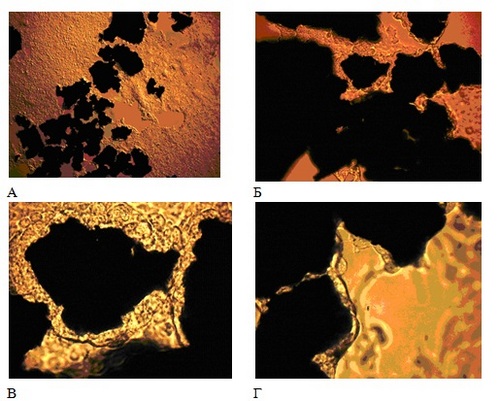
Рис. 13. Микрофотогрфии порошка никелида титана в процессе теста in vitro на биосовместимость. Видно, что клетки тканей печени человека в контакте с частицами никелида титана не только выживают (А-В), но и демонстрируют тенденцию перемещаться с бионейтрального субстрата на поверхность частиц (Г).
Для испытаний на биосовместимость были изготовлены образцы ассоциата коллагеновой губки с никелид титана-серебряным нанокомпозитом (АКГНТСН). Образцы получены путем смешивания фрагментированной коллегановой губки «Стимул-Осс» производства ЗАО «Белкозин» (г. Луга, Россия). Для охрупчения губки с целью облегчения последующее фрагментации использовался жидкий азот. Размеры нитей коллагена, полученных в результате фрагментации составляли 100 нм – 1000 нм. Вторым компонентом ассоциата служил 2,5 % раствор колларгола (нанофазного серебра). Третьим компонентом ассоциата являлся нанофазный порошок никелида титана с размером частиц до 100 нм. Для получения унидозы ассоциата компоненты смешивались в следующих соотношениях: коллагеновая губка – 15 мг, раствор колларгола 2,5% - 100 мкл, порошoк пористого никелида титана – 5 мг. Компоненты смешивались под воздействием ультразвука в течение 6 мин.
Для изучения биобезопасности АКГНТСН в концентрациях, использованных для реконструкции челюстных костей, были проведены его испытания на острую токсичность, хроническую токсичность и цитостатический эффект с помощью первичных культур клеток человека.
Для исследования использовали культуры мезенхимальных клеток костного мозга (МККМ) получали из губчатого вещества гребня подвздошной кости, Свежие фрагменты ткани стерилизовали двадцатикратной обработкой средой следующего состава: RPMI 1640 (Sigma) – 47,5%, DMEM (Sigma) – 47,5%, фетальная бычья сыворотка - FCS (Sigma) – 5%, суплемент, содержащий селен, ферритин, инсулин, сахарозу x1 (Sigma), гентамицин, пенициллин, стрептомицин, фунгизон (Sigma). Затем фрагменты отмывали пятикратно раствором Хенкса и обрабатывали 1%-ным раствором клостридиальной коллагеназы в течение 20 минут при 370 в атмосфере 6% CO2.Ткани после вышеописанной обработки диссоциировала на отдельные клетки. Клетки ресуспендировали в среде, содержащей 80% смеси RPMI 1640 и DMEM (1:1), 20% FCS, суплемент, глютамин, антибиотики, меркаптоэтанол (0,01%), доводили до концентрации 100000 клеток на мл и рассевали на 75-сантиметровые флаконы (Nunc). Клетки культивировали при 370 С и 6% CO2 до достижения монослоя. Смену среды производили каждые 2 дня. На 12-ый день после посадки флаконы содержали 70-80% монослой. Клетки снимали смесью версена и трипсина и рассевали на покрытые полилизином 96-луночные плоскодонные планшеты (Flow) в концентрации 20000 в мл. Избыток клеток рассевали на 75-сантиметровые флаконы (Nunc) в в концентрации 200000 клеток в мл. МККМ образовывал монослой, мезенхимальных клеток.
Изучение острой токсичности АКГНТСН проводили следующим образом. Монослойные клетки снимали смесью версена и трипсина и рассевали на 6-луночные плоскодонные планшеты (Flow) в концентрации 20000 в мл. При этом имелось 3 варианта. Планшеты помещали на сутки в CO2-инкубатор. В часть планшетов перед посадкой в лунки помещали АКГНТСН по схеме, приведенной ниже В течение суток клетки МККМ распластывались и начинали делиться. Через 24 часа после посадки клетки планшетов, в которые предварительно не вносили АКГНТСН обрабатывали различными разведениями препаратов по той же схеме:
| Концентрация препаратов | МККМ | ЭФ |
|---|---|---|
| 500 мкг/мл | x | x |
| 50 мкг/мл | x | x |
| 0 мкг/мл | x | x |
Каждый вариант был представлен тремя точками.
После окончания инкубации клетки обрабатывали витальным красителем, содержащим этидиум бромид и акридин оранжевый. Процент жизнеспособных клеток подсчитывали под люминесцентным микроскопом фирмы «Opton» при увеличении x400. При окраске используемым красителем ядра живых клеток окрашивались в зелёный цвет, а мёртвых – в красный. Данные по точкам каждого варианта усреднялись. Результаты оценки острой токсичности препаратов на культуры МККМ приведены в таблице 3.
Как видно из таблицы 3 достоверной дозозависимой токсичности исследуемых препаратов даже в концентрации, которая в 10 раз превосходит используемую в клинических ситуациях не обнаружено.
Для изучения хронической токсичности никелид титана -серебряного нанокомпозита использовали аналогичную схему. Отличием явился срок инкубации с исследуемыми препаратами, который составил 7 суток. Результаты исследования хронического токсического действия исследуемых препаратов на культуры клеток представлены в таблице 4.
Как видно из Таблицы.3 достоверной дозозависимой хронической токсичности препаратов АКГНТСН присутствии используемых и 10-кратно повышенных концентраций не выявлено ни при какой схеме введения Живые клетки при окраске использованным витальным красителем окрашиваются в зеленый цвет, а мертвые – в красный. Фотографии наглядно иллюстрируют отсутствие острого и хронического цитоксического действия никелид титана -серебряного нанокомпозита на клетки культуры костного мозга.
Цитостатическое действие препаратов АКГНТСН изучали двумя методами – окраской на активность митохондрий с использованием метилтиазолтетразолия, который превращается в формазан и после растворения в диметилсульфоксиде даёт синюю окраску, которая при длине волны 610 нм и с помощью окраски фиксированного параформальдегидом клеточного монослоя кристаллвиолетом, окраска которым учитывается при длине волны 590 нм. Схема эксперимента аналогична описанной выше. Статистически достоверного действие АКГНТСН на культуры клеток МККМ с предварительным и через 24 часа введением препарата, не удается обнаружить ни одним из использованных методов.
Таблица 3
Изучение острой токсичности препаратов АКГНТСН на культуры клеток МККМ и (количество живых клеток на 100 клеток).
| Концентрация препаратов | Количество живых клеток МККМ при предварительном введении препаратов | Количество живых клеток ЭФ при введении препаратов через 24 часа после посадки клеток |
|---|---|---|
| 500 мкг/мл | 97 | 97 |
| 50 мкг/мл | 99 | 98 |
| 0 мкг/мл | 98 | 99 |
Таблица 4
Изучение хронической токсичности препаратов препаратов АКГНТСН на культуру клеток МККМ (количество живых клеток на 100 клеток).
| Концентрация препаратов | Количество живых клеток МККМ при предварительном введении препаратов | Количество живых клеток МККМ при введении препаратов через24 часа после посадки клеток |
|---|---|---|
| 500 мкг/мл | 97 | 96 |
| 50 мкг/мл | 99 | 98 |
| 0 мкг/мл | 96 | 99 |
Выводы:
1. Никелид титана-серебряный нанокомпозит биобезопасен даже в высоких дозах, как и наночастицы входящих в него веществ - никелида титана и серебра.
2. Никелид-титановые имплантаты как без НТСН, так и в комбинации с никелид титана-серебряным нанокомпозитом являются биосовместимыми, причём биосовместимость имплантатов в присутствии НТСН , происходит значительно интенсивнее.
3. Присутствие исследованных нанокомпозитов на поверхности никелид-титановых имплантов повышает их биосовместимость.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. V. Brailovski, S. Prokoshkin, P. Terriault, F. Trochu, Shape Memory Alloys: Fundamentals Modeling and Applications, ETS Publ, Montreal, Canada, 2003, 851
2. Гюнтер В.Э. с соавт. Никелид титана. Медицинский материал нового поколения. Томск, Изд-во МИЦ, 2006. - 296 с.
3. Гизатуллин P.M. Лечение деструктивных форм хронического периодонтита комбинацией пористого никелида титана с остеопластическим препаратом КоллапАН-гель». Сборник «Биосовместимые материалы с памятью формы и новые технологии в стоматологии», 2006 г.
4. Гюнтер В.Э., Дамбаев Г.Ц., Сысолетин П.Т. и др. Медицинские материалы и имплантанты с памятью формы. Томский ГУ, Томск, 1998, 488с. 5. Материалы с памятью формы и новые технологии в медицине/Под ред. проф. Гюнтера.- Томск; Изд-во «НПП МИЦ», 2007, с. 177-179.
6. K.E. Inaekyan, S.D. Prokoshkin, V. Brailovski, et al., Mater. Sci. Forum 503–504 (2006) 597.
7. V. Brailovski, S. Prokoshkin, , et al., Mater. Trans. JIM 47 (2006) 795.
8. В.В. Столяров, Е.А. Прокофьев, С.Д. Прокошкин, и др. Структурные особенности, механические свойства и эффект памяти формы в сплавах TiNi, полученных равноканальным угловым прессованием // Физика металлов и металловедение. 2005. Т.100. №6. С.91.
9. Pushin V.G., Gunderov D.V., Kourov N.I., et al Nanostructures and phase transformations in TiNi shape memory alloys subjected to severe plastic deformation // Ultrafine grained materials III / TMS, Charlotte: NC, USA. 2004. P. 481-486.
10. Valiev R.Z., Islamgaliev R.K., Alexandrov I.V. Bulk nanostructured materials processed by severe plastic deformation // Progr. Mater. Sci. 2000. V. 45. № 2. P. 103-189.
11. Lin H.C., Wu S.K. Strengthening effect on shape recovery characteristic of the equiatomic TiNi alloy // Scripta Met. et Mater. 1992. V. 26. № 1. P. 59-62.
12. Ильевич А.П. Механическое оборудование керамических и стекольных заводов. М., Промстройиздат, 1952.-676.
13. В. С. Раковский, В. В. Саклинский. Металлокерамика в машиностроении. М., Машгиз, 1956.
14. Измерения в промышленности. Справ. Иза. В 3-х кн., кн.2. Способы измерения и аппаратура: пер. с нем/ Под ред. Профоса П.-М., Металлургия. 1990. 384.
15. Морозова СП., Борисенко Н.И., и др. Размол твердосплавной шихты в шаровой мельнице на закритической скорости. Журн. Технический прогресс в атомной промыш-ленности.№1, 2001г. АТОМПРЕССА, Москва-Электросталь, с.62-66.
16. Порошковая металлургия. Спечённые и композиционные материалы. Под ред. В. Шатта. Пер. с нем., М., Металлургия, 1983, 520 с.с ил.
© Н.И.Борисенко, Р.М.Гизатуллин, Е.И.Зарайский
ДОСТИЖЕНИЯ И ПРОБЛЕМЫ СОВРЕМЕННОЙ МЕДИЦИНЫ.Сборник статей Международной научно-практической конференции, Уфа РИЦ БашГУ, 2014, 35-54 с.


